AABB认证咨询--CAR-T细胞治疗的一般流程
CAR-T治疗又称嵌合抗原受体T细胞治疗,是将人的T细胞经过基因工程手段体外修饰改造后,回输至患者体内,用于治疗疾病。
目前生产CAR-T细胞疗法的主要步骤包括最初分离和富集T细胞、T细胞活化、使用病毒或非病毒载体系统进行CAR基因转移、体外CAR-T细胞扩增,CAR-T细胞质控以及最后的末端工艺和冷冻保存,整个制造周期一般需要2~4周。
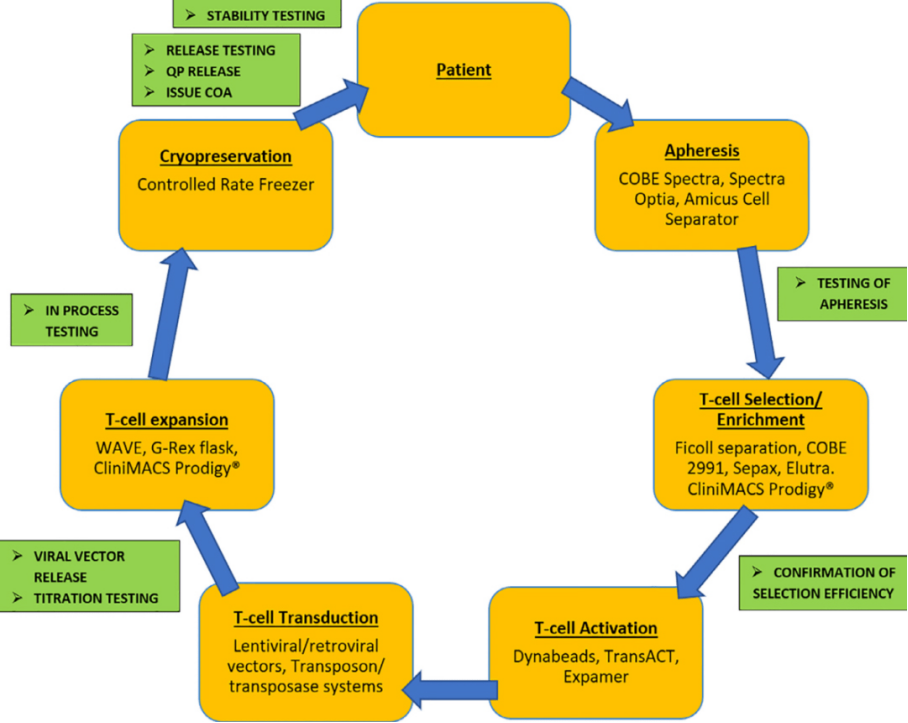
CAR-T生产的各个阶段和工艺方案示例
分离及富集T细胞
生产CAR-T的第一步,是通过白细胞分离术从患者(或同种异体的供体)处收集外周血单核细胞(PBMC);然后利用基于磁珠的技术分离出特定的T细胞亚群,如CD4+、CD8+、CD25+或CD62L+T细胞。
CAR-T载体构建及包装
实现CAR在T细胞上的表达是CAR-T生产的核心技术,这一步需要利用到载体将CAR基因导入T细胞。理想的载体应该具有较高的基因转染效率、稳定性好,不引起机体免疫反应等特点。
目前有多种方法用于T细胞修饰,包括病毒载体转导 (如γ-逆转录病毒、慢病毒载体等)及非病毒载体转染(转座子转染、电穿孔等技术等)。其中慢病毒转导应用较为广泛。

慢病毒载体设计可以用来实现哪些实验目的?
- 通过引入组织特异性启动子和/或miRNA靶基因实现组织特异性表达,消除脱靶效应;
- 用单个载体表达多个蛋白质可以通过使用IRES、双向启动子或由自切割的2A多肽分开多可读框;
- shRNA和miRNA表达;
- 生成cDNA、shRNA和miRNA文库;
- 由药物调节的基因表达。
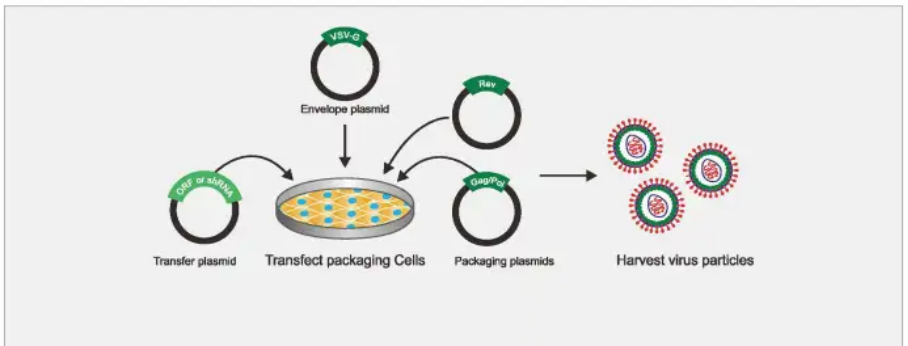
LV载体制备
LV生产的上游工艺主要包括细胞培养 (分为悬浮/贴壁培养等)和病毒包装;下游工艺一般涉及澄清、纯化、过滤、浓缩、除菌等步骤。与细胞分离步骤一样,载体的无菌性至关重要,因为最终的CAR-T细胞产物无法通过过滤进行灭菌。
EndoFree Plasmid Kits基于阴离子交换技术,将高效的内毒素去除步骤整合到质粒纯化流程中,不需要额外步骤,也不需用亲和柱去除脂多糖,可快速获得<0.1 EU/µg的质粒DNA。
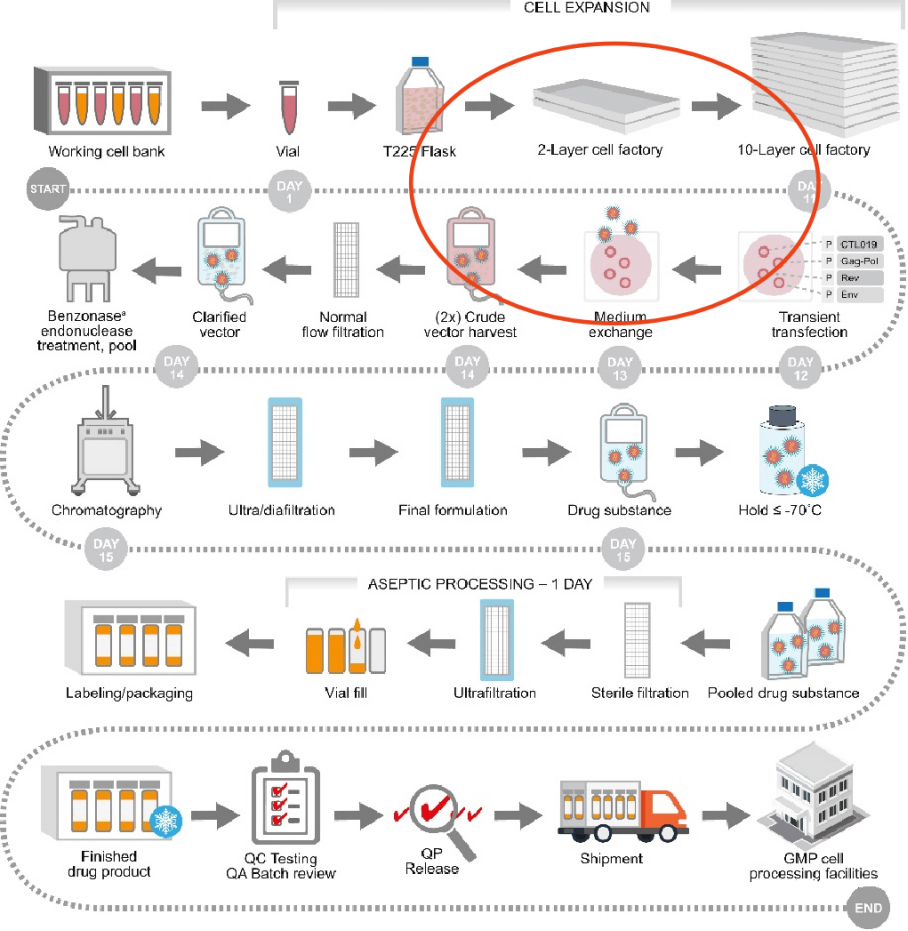
Oxford BioMedica为诺华Kymriah代工的慢病毒制造流程
T细胞扩增
体外培养,大量扩增CAR-T细胞至治疗所需剂量,一般为十亿至百亿级别。
CAR-T细胞质控
回输CAR-T细胞,严密监护病人,观察疗效并严密监测不良反应。
参考文献:
[1] Claire, Roddie, Maeve, et al. Manufacturing chimeric antigen receptor T cells: issues and challenges.[J]. Cytotherapy, 2019.[2] Levine B L, Miskin J, Wonnacott K, et al. Global Manufacturing of CAR T Cell Therapy[J]. Molecular Therapy Methods & Clinical Development, 2017, 4(C): 92-101.[3] Sakuma T, Barry M A, Ikeda Y. Lentiviral vectors: basic to translational[J]. Biochem J, 2012, 443(3): 603-618. [4] J.萨姆布鲁克, D.W.拉塞尔. 分子克隆实验指南[M]. 科学出版社, 2002.
END
免责声明:
本团队专注于介绍全球CGT行业研究进展。
本文仅作信息交流之目的,文中观点不代表本团队立场,亦不代表细胞与基因支持或反对文中观点。
本文并非治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
下一篇:已是最后一篇新闻
(1).23e3596.png)
























.2f44860.png)
 18576401396
18576401396 .36720e2.png)
.43b2c75.png)
.4f4ea8a.png)
.a3a1a2a.png)
